CENTRIFUGACIÓN
QUÍMICA INORGÁNICA.
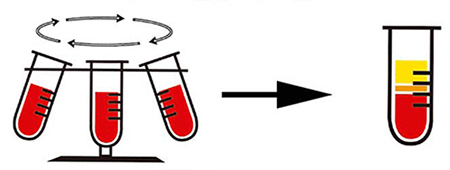
La centrifugación es uno de los metodos de separacion de mezclas que puede usarse cuando la sedimentación es muy lenta; para acelerar esta operación la mezcla se coloca en un recipiente que se hace girar a gran velocidad; por acción de la fuerza centrifuga los componentes mas pesados se sedimentan mas rápidamente y los livianos quedan como sobrenadante. Luego la operación que se sigue es la decantación.
 [1]
[1]Instrumental
1. Tubos
De vidrio o plástico. Resistentes químicamente (disolventes, reactivos) y físicamente (tensión a las velocidades elevadas que se emplean). Diversos tamaños y formas. Plásticos especiales para altas velocidades.
 [2]
[2]2. Centrífugas
Se puede regular velocidad, tiempo, temperatura. Elevadas velocidades (102-105 rpm).
3. Rotores
| Dos tipos: | rotor angular o de ángulo fijo | rotor basculante |
Modalidades
Según la velocidad:
| Criterio aproximado: | |
| Centrifugación a baja velocidad | menos de 10.000 rpm |
| Centrifugación a alta velocidad | entre 10.000 y 20.000 rpm |
| Ultracentrifugación | más de 20.000 rpm |
Según el propósito:
1. Centrifugación analítica
Objetivo: medir las propiedades físicas de las partículas que sedimentan, tales como su coeficiente de sedimentación o su masa molecular. Especialmente en la variante ultracentrifugación analítica.
Las moléculas se observan mediante un sistema óptico durante la centrifugación. Los tubos de centrífuga deben ser de cuarzo para dejar pasar la luz visible y ultravioleta. Rotor basculante, observación en vertical.
2. Centrifugación preparativa
De uso más común. Objetivo: aislar partículas, células o moléculas para su análisis o utilización posterior. En general, se emplea mayor cantidad de muestra que en la analítica.
Según el medio en el que se centrifuga y la forma como se aplica la muestra:
1. Centrifugación diferencial
(También llamada de frontera móvil). El tubo se llena con muestra y se centrifuga. El comportamiento de cada componente de la muestra depende de su forma, tamaño, densidad y, lógicamente, de las condiciones de centrifugación. Se obtienen sólo 2 fracciones: sedimento y sobrenadante.
[Nota: la palabra precipitado es más adecuada para algo insoluble, que precipita por centrifugación o por otros mecanismos (por ej., una reacción química); sedimento es más correcto para lo que se ha forzado a ir al fondo pero seguiría siendo soluble; pellet es una palabra inglesa para lo que queda compactado en el fondo como consecuencia de la centrifugación]
Una aplicación típica es el fraccionamiento subcelular (separación de los distintos componentes de una célula, principalmente de los orgánulos) (véase Luque o Alberts) empleando sucesivas centrifugaciones a velocidad creciente.
2. Centrifugación zonal o de velocidad de sedimentación
La muestra se aplica en una capa delgada sobre el medio de centrifugación, que es un gradiente de densidad. Bajo la fuerza centrífuga, las partículas sedimentan a través del gradiente concentrándose en zonas o bandas discretas. Su velocidad de avance (y, por tanto, el mecanismo de la separación) depende de su tamaño, forma y densidad; todos estos parámetros se combinan en el coeficiente de sedimentación,
que se mide en unidades svedberg (1 S = 10−13 segundos).
La centrifugación debe terminar antes de que alguna de las partículas separadas llegue al fondo del tubo. Los componentes separados se recogen individualmente aspirando con mucho cuidado las diferentes bandas o, mejor, perforando el fondo del tubo y recogiendo en fracciones el líquido que cae.
Puede verse una animación de la separación.
El gradiente de densidad se crea mediante un gradiente de concentración: concentraciones crecientes, al bajar en el tubo, de un componente adecuado. Se usan para ello sacarosa, cloruro de cesio, albúmina, suero fetal bovino..., o medios comerciales como Ficoll –un polisacárido sintético–, Percoll, metrizamida....
Se puede preparar:
a) un gradiente discontinuo o escalonado, manualmente
b) un gradiente continuo, empleando un dispositivo formador de gradientes
c) un gradiente continuo autoformado, si se crea mediante centrifugación, normalmente a la vez que se fracciona la muestra
a) un gradiente discontinuo o escalonado, manualmente
b) un gradiente continuo, empleando un dispositivo formador de gradientes
c) un gradiente continuo autoformado, si se crea mediante centrifugación, normalmente a la vez que se fracciona la muestra
Centrifugación zonal.
A) Preparación de un gradiente continuo de densidad usando un mezclador.B) Aplicación de la muestra sobre el gradiente. C) Colocación de los tubos en un rotor basculante y centrifugación. D) Recogida en fracciones de los componentes separados. |
Con esta técnica se consigue, por ejemplo, separar todos los tipos celulares sanguíneos, purificar espermatozoides viables, separar células viables y no viables de tejidos desagregados y muestras con células en suspensión, etc.
3. Centrifugación isopícnica o de equilibrio de sedimentación
Se utiliza también un gradiente de densidad, pero en este caso el tiempo de centrifugación es lo suficientemente largo (hasta 1 o 2 días) como para que se alcance el equilibrio de sedimentación (entre la fuerza centrífuga, el empuje hidrostático de la célula y su difusión). Para conseguirlo, se usan gradientes continuos que cubren todo el intervalo de densidades de los componentes de la muestra: en el fondo del tubo la densidad del medio ha de ser mayor que la del componente más denso. De esta forma, independientemente del tiempo de centrifugación, las partículas, células, etc. nunca sedimentarán en el fondo, sino que alcanzan una posición estable intermedia en el gradiente, donde se concentran en una banda muy estrecha (mejor resolución). Lo más frecuente es mezclar la muestra con el material que formará el gradiente y generar un gradiente autoformado a la vez que se hace la separación. Requiere velocidades muy altas (ultracentrifugación) para que se forme el gradiente.
Además de la mayor resolución, lo interesante de esta técnica es que separa exclusivamente según la densidad de los componentes de la muestra, que se sitúan en la posición del gradiente donde la densidad del medio es igual a la suya propia (isopícnica = de igual densidad, en griego).
Comparación e información adicional:
| Centrifugación diferencial | Centrifugación zonal o de velocidad de sedimentación | Centrifugación isopícnica o de equilibrio de sedimentación | |
|---|---|---|---|
| (en gradiente preformado, continuo o discontinuo) | (generalmente en gradiente preformado o auto-formado, continuo) | ||
| Rotor angular, generalmente. Separación en función principalmente del tamaño, pero también del coeficiente de sedimentación s, que depende de la masa (tamaño × densidad) y de la forma. (medido en Svedbergs, 1S = 10-13 segundos) Aplicación: separación de tipos celulares, fraccionamiento subcelular (separación de orgánulos), separación de asociaciones macromoleculares, etc. | Rotor basculante. Separación en función del coeficiente de sedimentación s, que depende de masa y forma. El gradiente evita la mezcla por convección/difusión: bandas bien separadas. Se detiene la centrifugación antes de alcanzar el equilibrio. Densidad máxima del gradiente < densidad de los componentes de la muestra. Aplicación: separación de macromoléculas, de orgánulos similares, etc. | Rotor basculante. Separación en función de la densidad. El gradiente evita la mezcla por convección/difusión: bandas bien separadas. El tiempo de centrifugación es lo suficientemente largo como para que se alcance el equilibrio. Densidad máxima del gradiente > densidad de los componentes de la muestra. Aplicación: separación de moléculas de ácido nucleico, purificación de ácidos nucleicos, etc. |
 [3]
[3]
4. Métodos de barrera
Método rápido, típico por ejemplo en la obtención de leucocitos de sangre circulante libres del resto de células sanguíneas. Se trata de una centrifugación a través de un medio de densidad constante (se podría considerar como un gradiente escalonado de una sola etapa). La densidad de este lecho debe ser intermedia entre la de los tipos celulares que se quieren separar. Se emplean para ello medios comerciales como Ficoll-Paque, Lymphoprep y otros muchos, formados generalmente por mezclas de Ficoll (un polisacárido sintético) y metrizamida (un compuesto sintético yodado). Se dispone de varios medios con densidades adecuadas para la separación de tipos celulares concretos; por ej., Nycoprep 1.077 para células mononucleares, Nycoprep 1.068 para monocitos, Polymorhoprep para células polimorfonucleares, o Nycoprep 1.063 para plaquetas.
BIBLIOGRAFIA
Manual del ingeniero químico, volumen IV. Perry.
Soluciones prácticas para el ingeniero químico. Carl R. Branan
Ingeniería bioquímica. Webb, F. C.
BIBLIOGRAFIA
Manual del ingeniero químico, volumen IV. Perry.
Soluciones prácticas para el ingeniero químico. Carl R. Branan
Ingeniería bioquímica. Webb, F. C.
Que paso aquí?, este blog se ve desalineado verifiquen mínimo fuente de letra.
ResponderEliminarSaludos Cordiales
Hilda Cisneros